ТЕРАПИЮ
М.Д. Смирнова, д.м.н.
ФГБУ «Научный медицинский исследовательский центр Кардиологии» Минздрава России
Аннотация
Обзор посвящен одному из самых хорошо изученный блокатор рецепторов ангиотензина II(БРА)- кандесартану. Рассматриваются его фармакодинамика и фармакокинетика. Представлены результаты исследований доказывающий высокую гипотензивную эффективность кандесартана, эффективность его использования при сердечной недостаточности, нефро – и нейропротективные эффекты. Проводится сравнительная оценка эффективности БРА. Описан опыт использования препарата при гипертрофической кардиомиопатии, мигрени, а также новые перспективные направления.
Ключевые слова: кандесартан, артериальная гипертензия, сердечная недостаточность
Адрес для переписки: Смирнова Мария Дмитриевна, naliya1@yandex.ru
Для цитирования: М.Д. Смирнова/ Все ли сартаны одинаковы? Как выбрать оптимальную терапию/Фармакология & Фармакотерапия.2020/2. с. 00-00.
DOI 10.46393/2713-2129_2020_2_00-00
ARE ALL SARTANES THE SAME? HOW TO CHOOSE THE OPTIMAL
THERAPY
M.D. Smirnova, MD1
1FGBU "Scientific Medical Research Center of Cardiology" of the Ministry of Health of Russia
Abstract
The review is devoted to one of the best studied angiotensin II receptor blocker (ARB), candesartan, and its pharmacodynamics and pharmacokinetics are considered. The article presents the research results proving the high hypotensive efficacy of candesartan, the efficacy of its use in heart failure, nephro - and neuroprotective effects. A comparative assessment of the effectiveness of ARBs is carried out. The experience of using the drug in hypertrophic cardiomyopathy, migraine, as well as new promising directions is described.
Key words: candesartan, arterial hypertension, heart failure
Correspondence address: Maria Dmitrievna Smirnova, naliya1@yandex.ru
For citation: M.D. Smirnova / Are all sartans the same? How to choose the optimal therapy / Pharmacology & Pharmacotherapy. 2020/2. from. 00-00.
DOI 10.46393 / 2713-2129_2020_2_00-00
Введение
Одна из причин неуспеха лечения и профилактики сердечно-сосудистых заболеваний (ССЗ) – инертность врачей. По крайней мере такой тезис выдвигает Европейское общество кардиологов (European Society of Cardiology) в последних рекомендациях и Европейское общество по артериальной гипертензии (European Society of Hypertension) [1]. Один из аспектов инертности – смешивание так называемых класс-эффектов с индивидуальными эффектами конкретных препаратов. Нагляд но иллюстрирует данную проблему утверждение «все сартаны одинаковы». Разумеется, это не так.
Действительно, все блокаторы рецепторов ангиотензина II (БРА) сартаны характеризуются общими свойствами (механизм действия, возможность однократного приема в сутки, хорошая переносимость и минимальные
побочные эффекты). Поскольку повышение активности ренинангиотензин-альдостероновой системы (РААС) является одним из основных патогенетических механизмов, лежащих в основе ССЗ на всех этапах сердечно-сосудистого континуума, препараты, блокирующие ее, ингибиторы ангиотензинпревращающего фермента (ИАПФ) и БРА, признаны важнейшим компонентом терапии ССЗ. Эффективность и безопасность сартанов как гипотензивных
препаратов подтверждены результатами ряда крупных метаанализов. Первый из них, включавший 29 рандомизированных контролируемых исследований
(РКИ) (n = 162 341), был опубликован в 2003 г. Показано, что БРА подобно другим гипотензивным препаратам основных классов – бета-блокаторам, антагонистам кальциевых каналов, диуретикам, ИАПФ способствуют сниже-
нию риска сердечно-сосудистых осложнений (ССО) на 10% [2]. Согласно данным большого метаанализа M.R. Law и соавт. (2009 г., 147 РКИ, n = 464 000), сартаны сопоставимо с препаратами других классов снижают не только
риск развития осложнений, связанных с ишемической болезнью сердца (ИБС), но и в большей степени риск инсульта [3]. A.U. Klingbeil и соавт., выполнив метаанализ 80 РКИ, установили, что БРА превосходят гипотензивные препараты иных классов по способности снижать массу миокарда левого желудочка [4]. Безусловно, речь идет о класс-эффектах. Однако, например, для
терапии хронической сердечной недостаточности (ХСН) рекомендованы только лозартан, валсартан и кандесартан. При подагре предпочтение отдается лозартану.иВ настоящее время группа БРА представлена восемью молекулами: лозартаном, валсартаном, кандесартаном, ирбесартаном, телмисартаном, олмесартаном, эпросартаном, азилсартаном. Несмотря на общие характеристики препаратов данного класса, между ними имеются и клинико-
фармакологические различия, что определяет их эффективность и выбор терапии в конкретном случае.
Цель настоящего обзора – ознакомить практических врачей, кардиологов и терапевтов, с доказательной базой одного из наиболее изученных БРА кандесартана.
Особенности фармакодинамики и фармакокинетики
По химической структуре кандесартана цилексетил, как и первый из сартанов лозартан, представляет собой бифениловое производное тетразола. Однако его ли-
пофильность превышает таковую лозартана. Кандесартана цилексетил легче проникает глубоко в ткани, обеспечивая как системную, так и местную (тканевую) блокаду РААС [5]. Кандесартана цилексетил относится к пролекарствам. При всасывании из желудочно-кишечного тракта он гидролизуется до активного вещества кандесартана. Биодоступность кандесартана цилексетила при приеме внутрь составляет 42% [6]. Одновременный прием пищи не влияет на биодоступность препарата, то есть его можно принимать до, после и во время еды. Максимальная концентрация кандесартана цилексетила в плазме (Cmax) достигается через три-четыре часа.
Препарат проникает через плацентарный барьер, но не проникает через гематоэнцефалический. Период полувыведения (Т1/2) – девять часов. Именно Т1/2 во многом определяет длительность действия препарата. Между тем в клинической практике
продолжительность действия оценивают не по Т1/2, а по длительности сохранения эффекта, в частности гипотензивного [5]. О длительности гипотензивного действия судят по отношению остаточной активности (через 24 часа после приема последней дозы) к пиковой (максимальное действие в момент максимальной концентрации препарата в крови) [5]. При однократном приеме кандесартана снижение артериального давления (АД) через 24 часа сравнимо со снижением АД на пике действия. Следовательно, препарат контролирует АД в течение более чем 24 часов. Длительность гипотензивного действия кандесартана подтверждают результаты исследования остаточного эффекта на фоне 48-часового пропуска приема препарата. Показано, что перерыв в приеме кандесартана, по данным суточного мониторирования, не сопровождается значимым повышением АД [7]. Такая продолжительность действия обусловлена прочностью связывания кандесартана с рецептором к ангиотензину II 1-го типа (AT1-рецептор) и его медленной диссоциацией из образовавшейся связи с ними. Даже избыточное количество ангиотензина II не может вытеснить кандесартан из связи с AT1-рецепторами [8]. Такой тип связи с рецептором получил название необратимой блокады AT1-рецепторов. Медленная диссоциация кандесарт-
ана из связи с рецепторами способствует его накоплению в среде и повторному связыванию с АТ1-рецепторами. По способности вытеснять ангиотензин II из связи
с AT1-рецепторами кандесартан также превосходит другие БРА. Сродство кандесартана к AT1-рецепторам примерно в 80 раз выше, чем у лозартана, и в десять раз выше, чем у его активного метаболита (ЕХР-3174) (рис. 1) [8, 9].
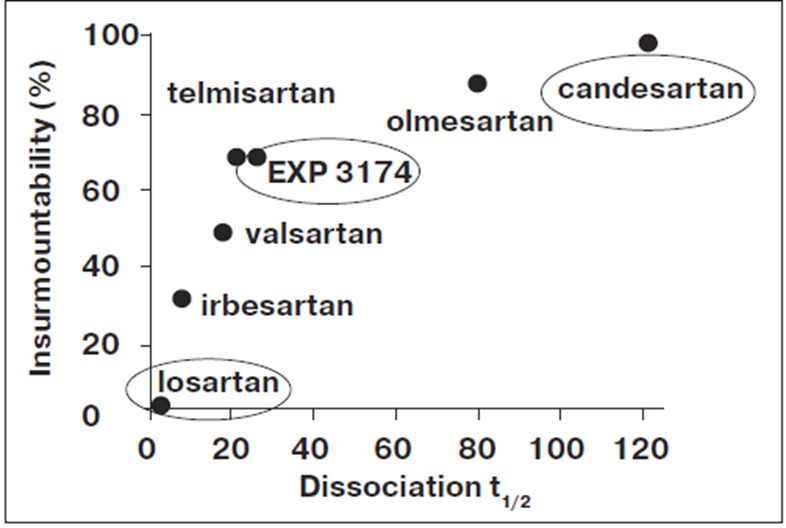
Рис. 1. Непреодолимость блокады АТ1-рецепторов различными БРА.
Препарат не кумулируется в организме. 20–30% кандесартана метаболизируется в печени при участии цитохрома CYP 2C с образованием неактивного метаболита [6]. Большая часть препарата выводится с желчью (67%) или мочой (33%) в неизмененном виде. Такой двойной путь выведения делает препарат более безопасным у лиц с ослабленной функцией печени или почек. У пациентов старше 65 лет Cmax кандесартана на 50% выше, чем у более молодых. Между тем ни его гипотензивное действие, ни частота побочных эффектов от возраста не зависят. Следовательно, нет необходимости корректировать дозу препарата в зависимости от возраста [6]. При легком и умеренном нарушении функции почек Cmax кандесартана увеличивается на 50%, тогда как T1/2 не изменяется по сравнению с показателями у больных без нарушения почечной функции [6]. У пациентов с тяжелым нарушением функции почек Cmax препарата также увеличивается на 50%, но T1/2 возрастает в два раза. У тех, кто находится на гемодиализе, фармакокинетические параметры кандесартана аналогичны таковым у пациентов с тяжелым нарушением функции почек. Таким образом, при тяжелых нарушениях функции почек дозу кандесартана необходимо корректировать [6].
Гипотензивная эффективность кандесартана
Последние годы особое внимание уделяется плейотропным эффектам гипотензивных препаратов. Тем не менее не следует забывать, что именно снижение АД – первичная задача лечения гипертонии. Степень снижения АД, как
систолического (САД), так и диастолического (ДАД), коррелирует
со снижением риска ССО. Этот постулат подтвержден в posthoc-анализах крупнейших РКИ, таких как VALUE, ONTARGET, TRANSCEND, SPRINT.
Показано, что более интенсивное снижение САД <130 мм рт. ст. позволяет добиться дополнительного уменьшения риска развития инфаркта миокарда, инсульта и даже смерти [10–13]. В метаанализе D. Ettehad и соавт. (123 РКИ, n = 613 815) продемонстрировано, что снижение САД на каждые дополнительные 10 мм рт. ст. сопровождается уменьшением риска ССО на 20%, инсульта – на 27% и смерти – на 13%. Максимальное снижение риска отмечается при уровне САД <130 мм рт. ст. [14]. Сказанное означает, что «мощность» гипотензивного препарата должна обязательно учитываться при его назначении. В 2011 г. был опубликован метаанализ 12 РКИ с участием 3644 пациентов, посвященный
сравнению гипотензивной эффективности кандесартана и лозартана. Кандеартан превзошел лозаратан по степени снижения АД (ΔСАД -2,97; 95%-ный
доверительный интервал (ДИ) -4,18–-1,77; p < 0,001; ΔДАД -1,76; 95% ДИ -2,57–-0,96; p < 0,001). Доля ответивших на терапию кандесартаном была выше (отношение шансов (ОШ) 1,12; 95% ДИ 1,06–1,18; p < 0,01), равно как и доля больных, контролировавших АД (ОШ 1,26; 95% ДИ 1,06–1,50; p = 0,008). Важный момент: число серьезных нежелательных событий в группе кандесартана было на 52% меньше, чем в группе лозартана (p = 0,03) [15]. Еще больший интерес представляют исследования сравнительной «мощности» кандесартана
и других БРА. В ряде небольшихиРКИ сравнивали гипотензивную эффективность телмисартана – одного из самых мощных сартанов и кандесартана. Эти
исследования, в которых в общей сложности участвовало 302 пациента, вошли в метаанализ, опубликованный в 2019 г. Гипотензивный эффект указанных
препаратов оказался сопоставимым [16]. В многоцентровое РКИ, посвященное сравнению гипотензивно го эффекта трехмесячной терапии валсартаном 80 мг, телмисартаном 40 мг и кандесартаном 8 мг, было включено 308 больных артериальной гипертензией (АГ) и сахарным диабетом (СД) 2-го типа. Снижение САД и ДАД было сопоставимо во всех трех группах [17]. Показано, что гипотензивная эффективность кандесартана превосходит таковую лозартана,
валсартана и ирбесартана [18], а также эпросартана и телмисартана [19]. Таким образом, кандесартан превосходит лозартан, как минимум сопоставим по мощности с валсартаном, ирбесартаном и телмисартаном, хотя, возможно, уступает олмесартану [20].
Эффективность кандесартана при ХСН
Кандесартан – один из БРА, рекомендованных для лечения ХСН [21]. Основанием для его внесения в соответствующие рекомендации послужило исследование CHARM [22]. Программа CHARM состояла из трех отдельных РКИ. Первое – CHARM-Added включало 2548 больных ХСН с фракцией выброса левого желудочка (ФВ) <40% (в среднем 28%), которым назначали стандартную терапию ИАПФ. Дополнительно к этому лечению больные получали кандесартан либо плацебо. Во второй ветви программы – CHARM-Alternative 2028 больных ХСН с ФВ < 40% (в среднем 30%), которые по каким-либо причинам не могли принимать ИАПФ, были также рандомизированы на группы кандесартана и плацебо. 3025 больных ХСН с сохранной ФВ (> 40%, в среднем 54%), принимавшие или не принимавшие ИАПФ, стали участниками третьей ветви – CHARM-Preserved. Они также были рандомизирова ны на группы кандесартана и плацебо. Первичной конечной точкой программы была общая смерт ность, а для каждой из ее ветвей – сердечно-сосудистая смерть или госпитализация вследствие декомпенсации ХСН. Продолжительность наблюдения составила в среднем 37,7 месяца. Доза кандесартана титровалась до 32 мг/сут. Целевой дозы удалось достичь 63% больных. Показатель общей смертности в группе кандесартана был меньше, чем в группе плацебо (886 (23%) и 945 (25%) соответственно, ОШ 0,91; 95% ДИ 0,83–1,00; p = 0,055). Первичная конечная точка в CHARM-Added в группе кандесартана была меньше на 15% (p = 0,01) [22], в CHARMAlternative – на 23% (p < 0,0001) [23]. В CHARM-Preserved в группе кандесартана также отмечалось снижение данного показателя (на 11%), но оно оставалось на уровне тенденции (p = 0,051) [24].
Авторы исследования пришли к выводу, что применение кандесартана высоко эффективно при сердечной недостаточности с систолической дисфункцией левого желудочка. При добавлении кандесартана к терапии ИАПФ у больных такой же категории могут иметь место дополнительные плюсы, хотя в этом случае возрастает риск побочных эффектов. В группе пациентов с сохраненной функцией левого желудочка эффективность кандесартана ниже. Дополнительное преимущество кандесартана заключается в уменьшении относительного риска развития фибрилляции предсердий по сравнению с плацебо: на 19% в общей группе и на 22% у пациентов с ФВ <40% [25]. Насколько сопоставимы эффекты различных БРА при ХСН? К сожалению, прямых сравнительных РКИ не проводилось. Однако в 2011 г. были опубликованы данные Шведского регистра (Swedish Heart Failure Registry) больных ХСН со сниженной ФВ [26]. Целью регистра была сравнительная оценка эффективности двух БРА – лозартана и кандесартана. Конечной точкой служила общая смертность через год и пять лет. В регистр включены данные 5139 больных (средний возраст – 74 года, 61% мужчин). 2500 пациентов получали лозартан, 2639 – кандесартан. Исследование проводилось в период 2000–2009 гг. Одногодичная выживаемость в группе кандесартана составила 90% (95% ДИ 89–91%), в группе лозартана – 83% (95% ДИ 81–84%), пятилетняя – 61 (95% ДИ 54–68%) и 44% (95% ДИ 41–48%) соответственно (p <0,001). Многофакторный анализ риска смерти продемонстрировал преимущество кандесартана перед лозартаном – 1,43 (95% ДИ 1,23–1,65; p <0,001). Таким образом, по данным регистра, применение кандесартана ассоциируется с более низким риском смерти от всех причин по сравнению с лозартаном [26].
Нейропротективные свойства кандесартана
Одним из нерешенных вопросов на стыке неврологии и кардиологии остается необходимость и безопасность снижения АД в ранний период инсульта. В исследовании ACCESS была предпринята попытка ответить на этот вопрос [27]. В исследовании участвовало 500 пациентов. Критериями включения были моторный дефицит, компьютерная томография головного мозга, исключавшая внутричерепное кровоизлияние, и необходимость лечения АГ в соответствии с рекомендациями (САД ≥ 200 мм рт. ст. и/или ДАД ≥ 110 мм рт. ст. через 6–24 часа или САД ≥ 180 мм рт. ст. и/или ДАД ≥ 105 мм рт. ст. через 24–36 часа после поступления в стационар). Лечение начинали с 4 мг кандесартана ежедневно или плацебо в первый день. Далее дозу кандесартана или плацебо увеличивали до 8 или 16 мг, если уровень САД превышал 160 мм рт. ст. и/или ДАД 100 мм рт. ст. Терапия была направлена на снижение АД на 10–15% за 24 часа. Исследование было прекращено досрочно из-за значительного преимущества кандесартана в отношении снижения показателя смертности и количества ССО за 12 месяцев (ОШ 0,48; 95% ДИ 0,25–0,90). Согласно полученным результатам, при сопоставимом АД семидневное лечение кандесартаном, начатое в течение 24 часов после развития моторного дефицита, связанного с острым нарушением мозгового кровообращения (ОНМК), снижает совокупную 12-месячную смертность (7,2 и 2,9% для плацебо и кандесартана соответственно) и ССО (18,7 и 9,8% соответственно). Не выявлено значимой разницы ни в сопутствующей терапии, ни в количестве побочных эффектов. Таким образом, кандесартан не только безопасен для лечения пациентов в периоде острого инсульта, но и способен улучшить прогноз заболевания. Исследователи пришли к выводу, что кандесартан является эффективным и безопасным терапевтическим вариантом при условии, что противопоказания к ранней гипотензивной терапии отсутствуют [27]. Вместе с тем в более крупном исследовании SCAST (Scandinavian Candesartan Acute Stroke Trial) с участием свыше 2000 больных ОНМК с повышением АД в остром периоде кандесартан не продемонстрировал протективного эффекта [28]. Препарат также назначали в первые 30 часов заболевания, в течение семи дней дозу титровали от 1 до 16 мг/сут. За этот период достигнуто достоверное снижение АД на фоне приема препарата по сравнению с группой плацебо. Однако преимущества в плане улучшения прогноза не зафиксировано, в частности при геморрагическом инсульте. Впрочем, и данных о вреде такого лечения не получено. Дискутабельным остается и вопрос о риске развития деменции при снижении АД у пожилых пациентов. В исследовании SCOPE (The Study on Cognition and Prognosis in the Elderly), проходившем в 1997–2002 гг. в 15 странах, участвовало почти 5000 пациентов в возрасте от 70 до 89 лет с уровнем САД при включении в исследование 160–179 мм рт. ст. и/или ДАД 90–99 мм рт. ст. [29]. 84% больных получали гипотензивные препараты исходно. В исследовании к ним добавляли либо кандесартан, либо плацебо. Средний срок наблюдения составил 3,7 года. Уровень АД сопоставимо снижался в обеих группах. В группе кандесартана риск ССО снизился на 10,9% по сравнению с группой плацебо, однако различие было статистически незначимо. Но все же риск нефатальных ОНМК оказался статистически значимо ниже, чем в группе плацебо, на 27,8%, а всех ОНМК – на 23,6%. Когнитивная функция на фоне нормализации АД одинаково хорошо улучшилась в обеих группах [29]. В последние годы появились экспериментальные данные о нейропротективном действии кандесартана, реализующемся за счет его противовоспалительного эффекта [30–32]. В настоящее время обсуждается гипотеза о гиперактивации АТ1-рецептора как важной детерминанте системного воспаления и патологических реакциях на стресс [30–32]. Согласно экспериментальным данным, AT1-рецепторы мозга участвуют в физиологическом контроле воспаления, цереброваскулярной функции и стресса.
Нефропротективные свойства кандесартана
Нефропротективный эффект кандесартана изучали в ряде РКИ. Полученные результаты продемонстрировали его способность снижать протеинурию и тормозить падение фильтрационной функции почек [33, 34]. Исследователи отметили дозозависимость антипротеинурического эффекта препарата [33]. В исследовании CALM с участием 199 больных АГ и СД 2-го типа кандесартан 16 мг не уступал лизиноприлу 20 мг ни по гипотензивному эффекту, ни по способности снижать микроальбуминурию [34]. Интерес также представляют небольшие исследования терапии кандесартаном у больных хронической почечной недостаточностью (ХПН) различной степени тяжести. Исследования, касающиеся данной проблемы, пока крайне редки и проводятся в малочисленной когорте пациентов. Так, в японском исследовании [35] участвовало всего 13 пациентов (семь – в группе кандесартана) с уровнем креатинина 2,53–5,95 мг/дл. АД у них поддерживалось на уровне ниже 140/90 мм рт. ст. за счет использования препаратов других групп. Конечными точками служили удвоение уровня креатинина в сыворотке крови, перевод на гемодиализ или смерть. Значимого различия между группой кандесартана и контроля по конечным точкам не зарегистрировано, однако в основной группе (кандесартан) достоверно снизилась протеинурия. Клиренс креатинина снизился только в контрольной группе (с 16,2 ± 5,7 до 10,4 ± 4,8 мл/мин × 1,73 м2 (p = 0,011)). Нефропроттивное действие кандесартана сохранилось и при трехлетнем наблюдении (p = 0,025). Эти результаты позволяют надеяться, что кандесартан способен оказывать протективное влияние на функцию почек даже при далеко зашедшей стадии ХПН. Тем не менее нельзя забывать, что, исходя из действующих рекомендаций, назначение кандесартана, как и других БРА, у больных с выраженной почечной недостаточностью (клиренс креатинина < 30 мл/мин × 1,73 м2) должно проводиться с большой осторожностью и под тщательным контролем уровня калия и креатинина. Дело в том, что клинический опыт применения препарата у пациентов с тяжелым нарушением функции почек или терминальной стадией почечной недостаточности (клиренс креатинина < 15 мл/мин × 1,73 м2) ограничен [6]. Интерес представляет исследование с участием 128 пациентов обоего пола (средний возраст – 56 лет) с АГ, находившихся на гемодиализе в связи с терминальной стадией ХПН [36]. Больные были рандомизированы на группы кандесартана 16 мг и лозартана 50 мг. Длительность лечения составила восемь недель. Оба препарата продемонстрировали эффективность и безопасность, но гипотензивное действие кандесартана было сильнее. Исследователи сделали вывод, что антагонисты рецептора ангиотензина II могут быть замечательным терапевтическим вариантом у пациентов с ХПН при гемодиализе и АГ.
Новые точки приложения кандесартана
Способность кандесартана уменьшать гипертрофию левого желудочка (ГЛЖ) при АГ была неоднократно доказана [37]. Имеется опыт применения препарата при необструктивной гипертро фической кардиомиопатии – заболевании, медикаментозное лечение которого считается чисто симптоматическим и не влияющим на прогноз и степень ГЛЖ. Тем не менее препарат показал эффективность в регрессе ГЛЖ. Эффективность кандесартана оказалась максимальной у носителей отдельных генетических детерминант гипертрофической кардиомиопатии – мутаций генов SS-миозина и сердечного миозинсвязывающего протеина C [38]. Достаточно неожиданная с позиции кардиолога точка прожения кандесартана – мигрень. Хорошо известен антимигренозный эффект неселективных бета-адреноблокаторов. Однако, согласно результатам ряда исследований, эффективность кандесартана 16 мг в предупреждении приступов мигрени сопоставима с таковой пропранолола 160 мг [39]. Причем профиль безопасности кандесартана при лечении пациентов с мигренью соответствует таковому плацебо [40]. В ряде экспериментальных исследований наблюдались противоопухолевые эффекты кандесартана. M. Rasheduzzaman и S.Y. Park (2018 г.) [41]
Заключение
Кандесартан – эффективный гипотензивный препарат, профиль переносимости которого аналогичен таковому плацебо. Сравнительные данные показывают, что кандесартан обладает гипотензивной эффективностью, по крайней мере не уступающей или даже превосходящей эффективность других БРА. Кандесартан эффективен при ХСН, даже терминальной стадии, оказывает нефропротективное действие, может использоваться как антимигренозный препарат. В настоящее время лечение БРА становится более доступным с экономической точки зрения, что обусловлено появлением дженериков (воспроизведенных препаратов). Дженерики с доказанной оригинальным препаратам биоэквивалентностью, но меньшей стоимостью повышают приверженность терапии больных АГ и ХСН. Дженерический кандесартан, например препарат Ангиаканд (ЗАО «Канонфарма продакшн»), произведенный в соответствии с требованиями GMP и с использованием европейской субстанции, делает лечение пациентов более доступным. Ангиаканд биоэквивалентен оригинальному препарату. Подтверждение тому – результаты исследования сравнительной фармакокинетики и биоэквивалентности препаратов Кандесартан, таблетки 32 мг (ЗАО «Канонфарма продакшн», Россия) и Атаканд, таблетки 32 мг («АстраЗенека АБ», SE-151 85 Содерталье, Швеция).
Литература
1. 2018 ЕОК/ЕОАГ Рекомендации по лечению больных с артериальной гипертензией. Рабочая группа по лечению артериальной гипертензии Европейского общества кардиологов (ЕОК, ESC) и Европейского общества по артериальной гипертензии (ЕОАГ, ESH) // Российский кардиологический журнал. 2018. Т. 23. № 12. С. 143–228.
2. Turnbull F. Blood Pressure Lowering Treatment Trialists' Collaboration. Effects of different blood pressure lowering regimens on major cardiovascular events: results of prospectively-designed overviews of randomised trials // Lancet. 2003. Vol. 362. № 9395. P. 1527–1535.
3. Law M.R., Morris J.K., Wald N.J. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: metaanalysis of 147 randomised trials in the context of expectations from prospective epidemiological studies // BMJ. 2009. Vol. 338. ID b1665.
4. Klingbeil A.U., Schneider M., Martus P. et al. A meta-analysis of the effects of treatment on left ventricular mass in essential hypertension // Am. J. Med. 2003. Vol. 115. № 1. P. 41–46.
5. Патеюк И.В. Потенциал кандесартана в лечении артериальной гипертензии и хронической сердечной недостаточности у коморбидных пациентов // Медицинские новости. 2018. № 6 (285). С. 43–47.
6. Регистр лекарственных средств // www.rlsnet.ru/mnn_index_id_5729.htm.
7. Weisser B., Gerwe M., Braun M., Funken C. Untersuchungen zur antihypertensiven Langzeitwirkung von Candesartan – cilexetil in verschiedenen Dosierungen unter dem Einfluß therapiefreier Intervalle // Arzneimittelforschung. 2005. Vol. 55. № 9. P. 505–513.
8. Сиренко Ю.Н., Донченко Н.В. Симпозиум «Место кандесартана в современной терапии сердечно-сосудистых заболеваний: обзор доказательств» // Артериальная гипертензия. 2011. № 4 (18). С. 141–153.
9. Van Liefde I., Vauquelin G. Sartan-AT1 receptor interactions: in vitro evidence for insurmountable antagonism and inverse agonism // Mol. Cell Endocrinol. 2009. Vol. 302. № 2. P. 237–243.
10. Julius S., Weber M.A., Kjeldsen S.E. et al. The Valsartan Antihypertensive Long-Term Use Evaluation (VALUE) trial: outcomes in patients receiving monotherapy // Hypertension. 2006. Vol. 48. № 3. P. 385–391.
11. ONTARGET Investigators, Yusuf S., Teo K.K., Pogue J. et al. Telmisartan, ramipril, or both in patients at high risk for vascular events // N. Engl. J. Med. 2008. Vol. 358. № 15. P. 1547–1559.
12. Telmisartan Randomised AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease (TRANSCEND) Investigators, Yusuf S., Teo K., Anderson C. et al. Effects of the angiotensin-receptor blocker telmisartan on cardiovascular events in high-risk patients intolerant to angiotensin-converting enzyme inhibitors: a randomised controlled trial // Lancet. 2008. Vol. 372. № 9644. P. 1174–1183.
13. SPRINT Research Group, Wright J.T.Jr., Williamson J.D., Whelton P.K. et al. A randomized trial of intensive versus standard blood-pressure control // N. Engl. J. Med. 2015. Vol. 373. № 22. P. 2103–2016.
14. Ettehad D., Emdin C.A., Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis // Lancet. 2016. Vol. 387. № 10022. P. 957–967.
15. Zheng Z., Shi H., Jia J. et al. A systematic review and meta-analysis of candesartan and losartan in the management of essential hypertension // J. Renin. Angiotensin. Aldosterone Syst. 2011. Vol. 12. № 3. P. 365–374.
16. Zhao D., Liu H., Dong P.A. Meta-analysis of antihypertensive effect of telmisartan versus candesartan in patients with essential hypertension // Clin. Exp. Hypertens. 2019. Vol. 41. № 1. P. 75–79.
17. Ozaki N., Nomura Y., Sobajima H. et al. Comparison of the effects of three angiotensin II receptor type 1 blockers on metabolic parameters in hypertensive patients with type 2 diabetes mellitus // Eur. J. Intern. Med. 2010. Vol. 21. № 3. P. 236–239.
18. Elmfeldt D., Olofsson B., Meredith P. The relationships between dose and antihypertensive effect of four AT1-receptor blockers. Differences in potency and efficacy // Blood Press. 2002. Vol. 11. № 5. P. 293–301.
19. Conlin P.R. Angiotensin II antagonists in the treatment of hypertension: more similarities than differences // J. Clin. Hypertens. (Greenwich). 2000. Vol. 2. № 4. P. 253–257.
20. Brunner H.R., Arakawa K. Antihypertensive efficacy of olmesartan medoxomil and candesartan cilexetil in achieving 24-hour blood pressure reductions and ambulatory blood pressure goals // Clin. Drug Investig. 2006. Vol. 26. № 4. P. 185–193.
21. Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение // Кардиология. 2018. Т. 58. № S6. С. 8–159.
22. Pfeffer M.A., Swedberg K., Granger C.B. et al. Effects of candesartan on mortality and morbidity in patients with chronic heart failure: the CHARM-Overall programme // Lancet. 2003. Vol. 362. № 9386. P. 759–766.
23. McMurray J.J., Ostergren J., Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial // Lancet. 2003. Vol. 362. № 9386. P. 767–771.
24. Granger C.B., McMurray J.J., Yusuf S. et al. Effects of candesartan in patients with chronic heart failure and reduced leftventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial // Lancet. 2003. Vol. 362. № 9386. P. 772–776.
25. Yusuf S., Pfeffer M.A., Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and preserved leftventricular ejection fraction: the CHARM-Preserved Trial // Lancet. 2003. Vol. 362. № 9386. P. 777–781.
26. Eklind-Cervenka M., Benson L., Dahlström U. et al. Association of candesartan vs losartan with all-cause mortality in patients with heart failure // JAMA. 2011. Vol. 305. № 2. P. 175–182.
27. Schrader J., Lüders S., Kulschewski A. et al. Acute Candesartan Cilexetil Therapy in Stroke Survivors Study Group. The ACCESS Study: evaluation of Acute Candesartan Cilexetil Therapy in Stroke Survivors // Stroke. 2003. Vol. 34. № 7. P. 1699–1703.
28. Jusufovic M., Sandset E.C., Bath P.M., Berge E., Scandinavian Candesartan Acute Stroke Trial Study Group. Blood pressurelowering treatment with candesartan in patients with acute hemorrhagic stroke // Stroke. 2014. Vol. 45. № 11. P. 3440–3442.
29. Lithell H., Hansson L., Skoog I. et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial // J. Hypertens. 2003. Vol. 21. № 5. P. 875–886.
30. Quinlan S., Merino-Serrais P., Di Grande A. et al. The Anti-inflammatory compound candesartan cilexetil improves neurological outcomes in a mouse model of neonatal hypoxia // Front Immunol. 2019. Vol. 10. ID 1752.
31. Torika N., Asraf K., Apte R.N., Fleisher-Berkovich S. Candesartan ameliorates brain inflammation associated with Alzheimer's disease // CNS Neurosci. Ther. 2018. Vol. 24. № 3. P. 231–242.
32. Trigiani L.J., Royea J., Lacalle-Aurioles M. et al. Pleiotropic benefits of the angiotensin receptor blocker candesartan in a mouse model of Alzheimer disease // Hypertension. 2018. Vol. 72. № 5. P. 1217–1226.
33. Rossing K., Christensen P.K., Hansen B.V. et al. Optimal dose of candesartan for renoprotection in type 2 diabetic patients with nephropathy: a double-blind randomized cross-over study // Diabetes Care. 2003. Vol. 26. № 1. P. 150–155.
34. Mogensen C.E., Neldam S., Tikkanen I. et al. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the candesartan and lisinopril microalbuminuria (CALM) study // BMJ. 2000. Vol. 321. № 7274. P. 1440–1444.
35. Tamura Y., Kosuga M., Yamashita M. et al. Renoprotective effects of angiotensin II receptor blocker, candesartan cilexetil, in patients with stage 4-5 chronic kidney disease // Clin. Exp. Nephrol. 2008. Vol. 12. № 4. P. 256–263.
36. Cice G., Ferrara L., Tagliamonte E. et al. Angiotensin-II receptor inhibitors in hemodialysed uremia patients with arterial hypertension: candesartan cilexitil versus losartan // Cardiologia. 1999. Vol. 44. № 12. P. 1071–1076.
37. Cuspidi C., Muiesan M.L., Valagussa L. et al. Comparative effects of candesartan and enalapril on left ventricular hypertrophy in patients with essential hypertension: the candesartan assessment in the treatment of cardiac hypertrophy (CATCH) study // J. Hypertens. 2002. Vol. 20. № 11. P. 2293–2300.
38. Penicka M., Gregor P., Kerekes R. et al. The effects of candesartan on left ventricular hypertrophy and function in nonobstructive hypertrophic cardiomyopathy: a pilot, randomized study // J. Mol. Diagn. 2009. Vol. 11. № 1. P. 35–41.
39. Stovner L.J., Linde M., Gravdahl G.B. et al. A comparative study of candesartan versus propranolol for migraine prophylaxis: a randomised, triple-blind, placebo-controlled, double cross-over study // Cephalalgia. 2014. Vol. 34. № 7. P. 523–532.
40. Tronvik E., Stovner L.J., Helde G. et al. Prophylactic treatment of migraine with an angiotensin II receptor blocker: a randomized controlled trial // JAMA. 2003. Vol. 289. № 1. P. 65–69.
41. Rasheduzzaman M., Park S.Y. Antihypertensive drug-candesartan attenuates TRAIL resistance in human lung cancer via AMPK-mediated inhibition of autophagy flux // Exp. Cell Res. 2018. Vol. 368. № 1. P. 126–135.

