В первой части обзорной статьи на основе современных клинико–экспериментальных зарубежных и отечественных исследований рассматриваются вопросы патогенеза симптомов нижних мочевых путей на фоне доброкачественной гиперплазии предстательной железы (СНМП/ДГПЖ) с позиций андрогенозависимости предстательной железы и нижних отделов мужского урогенитального тракта. Представлены современные эпидемиологические данные, свидетельствующие о наличии общих эпидемиологических трендов между СНМП/ДГПЖ и дефицитом тестостерона при естественном течении обоих заболеваний при старении мужчины, что может предопределять наличие между ними определенных патогенетических связей.
Ключевые слова: симптомы нижних мочевых путей (СНМП), доброкачественная гиперплазия предстательной железы (ДГПЖ), предстательная железа, дефицит тестостерона, возрастная эпидемиология.
Адрес для переписки: Игорь Адамович Тюзиков, phoenix-67@list.ru
Для цитирования: И.А. Тюзиков/Симптомы нижних мочевых путей на фоне доброкачественной гиперплазии предстательной железы (СНМП/ДГПЖ) и дефицит тестостерона– есть ли связи? Общие вопросы терминологии, методологии и возрастной эпидемиологии/Фармакология & Фармакотерапия/2020/1. с.65-73.
DOI 00.0000/0000-000-2020-1-00-00
Lower urinary tract symptoms against the background of benign prostatic hyperplasia (LUTS/BPH) and testosterone deficiency– are there any links?
General questions of terminology, methodology and age epidemiology.
I. A. Tyuzikov1
1LLC Medical Center "Tandem-Plus", Yaroslavl
Abstract
In the first part of the review article, based on modern clinical and experimental foreign and domestic studies, the issues of pathogenesis of lower urinary tract symptoms against the background of benign prostatic hyperplasia (LUTS/BPH) are considered from the standpoint of androgen dependence of the prostate and the lower parts of the male urogenital tract. Modern epidemiological data are presented, indicating the presence of common epidemiological trends between LUTR/BPH and testosterone deficiency in the natural course of both diseases in the aging of men, which may determine the presence of certain pathogenetic links between them.
Key words: lower urinary tract symptoms (LUTS), benign prostatic hyperplasia (BPH), prostate, testosterone deficiency, age-related epidemiology.
Correspondence address: Igor Adamovich Tyuzikov, phoenix-67@list.ru
For citation: I.A. Tuzikov/Symptoms of the lower urinary tract on the background of benign prostatic hyperplasia (LUTS / BPH) and testosterone deficiency - are there any connections? General questions of terminology, methodology and age-related epidemiology/Pharmacology & Pharmacotherapy/2020/1. s. 65-73.
DOI 00.0000/0000-000-2020-1-00-00
Введение
Научная история изучения доброкачественной гиперплазии предстательной железы (ДГПЖ) насчитывает не одно столетие, но ее патогенез до сих пор остается предметом научных исследований и дискуссий. Нужно ли продолжать изучать ДГПЖ сегодня? Странный вопрос – конечно, нужно, хотя бы потому, что это наиболее частое хроническое прогрессирующее заболевание мужчин, создающее реальную угрозу нормальному функционированию верхних мочевых путей, которое чревато при своем естественном развитии манифестацией такого грозного осложнения как острая задержка мочеиспускания (ОЗМ), повышающего потребности в хирургическом лечении заболевания, независимо от других возраст–ассоциированных заболеваний резко нарушающее качество жизни мужчины среднего и старшего возраста, привлекающее к себе огромный фармакотерапевтический потенциал и затраты систем здравоохранения в большинстве стран мира, а, главное, о чем можно судить по доступным рекомендациям и гайдлайнам, изучать патогенез ДГПЖ нужно потому, что до сих пор эффективных профилактических мер при данном заболевании человечество так и не разработало [1,2]. На протяжении всей истории научного изучения ДГПЖ и симптомов нижних мочевых путей (СНМП), связанных с ней, было сформулировано большое количество теорий этиопатогенеза, некоторые из которых сегодня представляются наиболее популярными (например, дигидротестостероновая теория, на основе которой удалось совершить фармакологический прорыв в создании нового эффективного класса препаратов для патогенетического лечения заболевания (ингибиторы 5–α–редуктазы) [3,4], а другие как бы ушли на второй план (теория тестостерон-эстрогенового баланса или теория стромально–эпителиального взаимодействия), так не выдав в клиническую практику каких–либо эффективных препаратов для лечения СНМП/ДГПЖ [5,6].
Долгое время создание препаратов для лечения ДГПЖ шло исключительно в одном локальном (органном) направлении и создавались препараты сначала преимущественного (селективного), а позднее – суперселективного влияния на патологический процесс в органе, и мы совершенно забыли, что в нашем организме все клетки, органы и ткани находятся в тесной связи и взаимодействии друг с другом, и что патологический процесс в одном из них способен вызвать болезнь в другом, и не только контактно, но и на расстоянии.
Более того, сегодня в урологическое мышление приходит новое понимание того, что системные гормонально–метаболические нарушения (ожирение, метаболический синдром, сахарный диабет 2 типа, дефицит гормона D, дефицит тестостерона, инсулинорезистентность, гипоксия, нарушения сна и др.), выявляемые у пациентов с СНМП/ДГПЖ, являются не простой их «пассивной гормонально–метаболической дискредитацией», а являются системными патогенетическими механизмами, вовлеченными в процессы инициации и прогрессирования простатической железистой и стромальной гиперплазии и СНМП, а значит должны выявляться и корректироваться, если мы хотим эффективно управлять СНМП/ДГПЖ или выйти на их патогенетическую профилактику [7,8].
В настоящее время существенно расширились наши прежние представления о патофизиологической сущности ДГПЖ. Сегодня сформулировано много новых интегративных теорий мультифакторного этиопатогенеза СНМП/ДГПЖ, основанных на существенной роли системных гормонально–метаболических механизмов и их взаимодействия в формировании «плацдарма» для развития нарушений гормонально–метаболического гомеостаза в предстательной железе, заканчивающихся развитием сначала гистологической (бессимптомной) простатической гиперплазии, а по мере прогрессирования – и симптоматической (сначала неосложненной, а затем и осложненной) ДГПЖ(теория нарушения холестеролового баланса в предстательной железе, теория хронического цитокинового воспаления предстательной железы, теория окислительного простатического стресса и т.д.) [9–11].
В этой связи правы те исследователи и клиницисты, которых сегодня становится все больше и больше, которые склонны рассматривать СНМП/ДГПЖ как системное гормонально–метаболическое заболевание и даже как дополнительный компонент метаболического синдрома (МС) у мужчин с точки зрения общности их современной эпидемиологии и патофизиологии [12–15].
C учетом известной выраженной андрогенозависимости предстательной железы и ключевой роли гормональной эндокринно–паракринно–аутокринно–интракринной системы «Тестостерон–5–α–редуктазы–5–α–дигидротестостерон (5–α–ДГТ)» в обеспечении ее метаболизма, гомеостаза и большинства параметров анатомо–функционального состояния органа в настоящее время именно управление тестостероном у гипогонадных (тестостерон–дефицитных) больных СНМП/ДГПЖ может оказаться уникальной эффективной дополнительной к стандартной терапии фармакотерапевтической опцией по улучшению результатов лечения этой группы пациентов [16–21].
Дефицит тестостерона (ДТ): краткий обзор современного состояния проблемы
Согласно большинству определений мировых, континентальных и российских научных сообществ, дефицит тестостерона (гипогонадизм)у мужчин определяется как клинико–биохимический синдром, связанный с низким уровнем тестостерона, а так же нечувствительностью рецепторного аппарата к андрогенам, который может оказывать негативное воздействие на множество органов и систем, ухудшая качество жизни и жизненный прогноз, поскольку андрогены, основным из которых является тестостерон, играют ключевую роль в развитии и поддержании репродуктивной и сексуальной функций мужской половой системы [22,23]. С возрастом у мужчин отмечается снижение уровня тестостерона (зафиксировано ежегодное снижение уровня циркулирующего тестостерона на 0,4-2,0% начиная с 30 летнего возраста) [24,25].
У мужчин среднего возраста без сопутствующей патологии распространенность гипогонадизма составляет 6% [26].
Распространенность гипогонадизма при ожирении и некомпенсированном сахарном диабете может превышать 50% [27], по данным некоторых мета-анализов – 70% [28].
Общепринятые клинические симптомы, подозрительные в отношении ДТ у мужчин, представлены ниже в таблице 1.
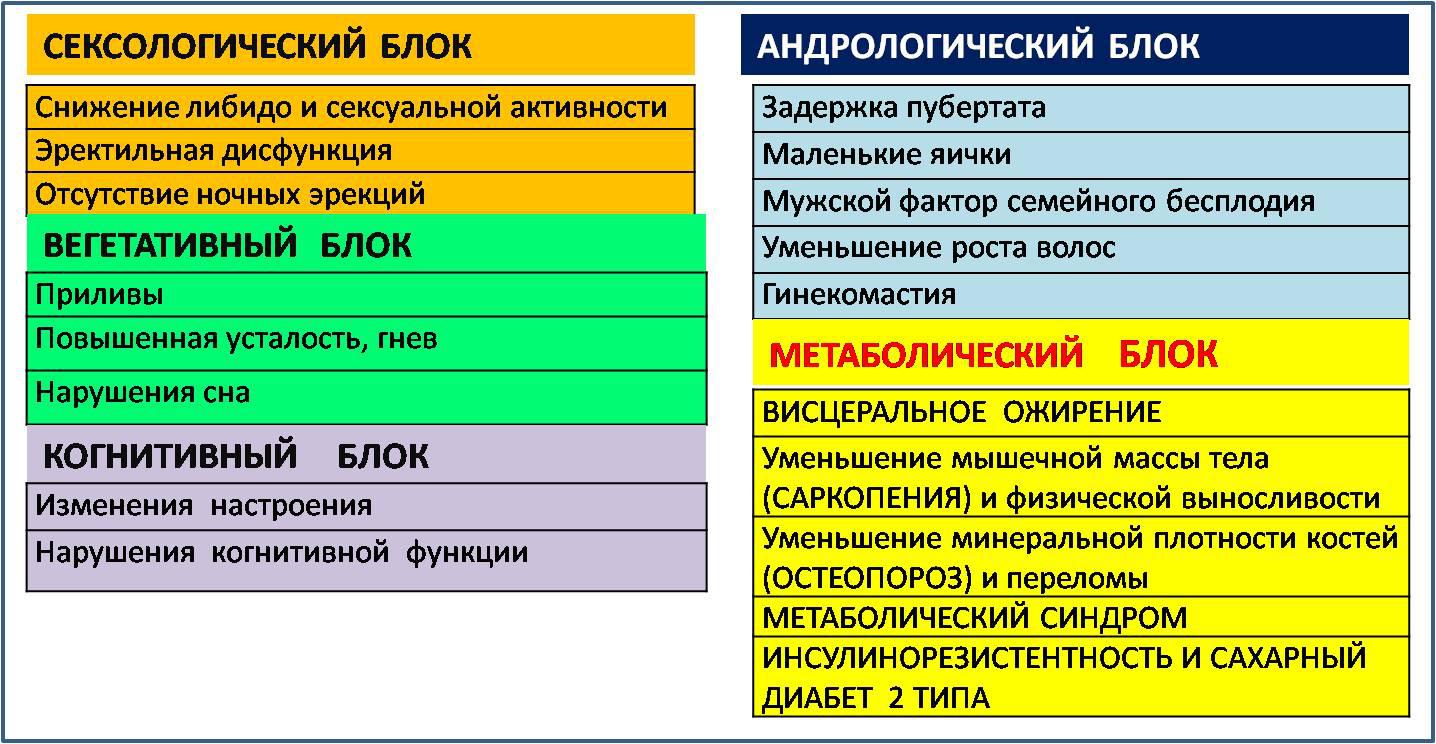
Таблица 1. Клинические симптомы, подозрительные в отношении ДТ у мужчин
В 2020 году эксперты Европейского общества урологов (EAU) предложили в качестве еще одного дополнительного клинического симптома ДТ у мужчин – умеренную анемию [29]. Согласно имеющимся клиническим рекомендациям, ДТ диагностируется при наличии одновременно клинических симптомов, ассоциированных с дефицитом тестостерона, и стойкого лабораторного снижения уровня тестостерона (как минимум двукратное подтверждение) надежным методом (доказательность 2, степень доказательности А) [23]. Кроме того, данное заболевание имеет собственный код в МКБ-10 Е. 29.1.
В настоящее время четко прописан минимальный лабораторный объем диагностики при ДТ (уровень в крови общего тестостерона (двукратно), лютеинизирующий гормон ЛГ, глобулин, связывающий половые стероиды (ГСПС), тиреотропный гормон ТТГ, пролактин, 25(ОН)–витамин D, а также прописана необходимость определения при погранично–низком общем тестостероне (8–12 нмоль/л) показателя свободного тестостерона по расчетной номограмме А. Вермюллена или специальной формуле на специализированных интернет–ресурсах. При этом в качестве нижней нормальной границы уровня общего тестостерона рекомендовано значение в 12,1 нмоль/л (3,46 нг/мл, или 346 нг/дл) при измерении методом жидкостной хроматографической масс-спектрометрии (мультистероидный анализ) (ISSAM, 2015) или усиленной хемилюминесценции (ЭНЦ, 2016) [23].
Кроме того, в имеющихся рекомендациях четко прописаны показания и противопоказания к назначению терапии тестостероном, сроки развития позитивной динамики в отношении различных групп симптомов, четко регламентированы потенциальные риски и методы соответствующего мониторинга. Вместе с тем, за последние несколько лет произошла определенная эволюция в противопоказаниях к тестостерон–заместительной терапии (ТЗТ), что можно рассматривать как отражение ее высокой безопасности. Так, из противопоказаний к ТЗТ в 2013 году исключен уровень ПСА>4 нг/мл, допустимая граница гематокрита крови, позволяющая безопасно продолжать ТЗТ, расширена с 50% до 54%, в 2015 году разрешено проведение ТЗТ при наличии к ней показаний у больных локальным раком предстательной железы (Т1–2) через 1 год после радикальной простатэктомии, а в 2018–2020 годах исключены СНМП/ДГПЖ как противопоказание к ТЗТ. Более того в рекомендациях EAU 2020 начинает четко прослеживаться смена взглядов на роль ДТ и его коррекция в течении СНМП/ДГПЖ. Постулирование того, что скорее низкий уровень андрогенов, а не повышенный, оказывает более негативное влияние влияет на состояние гладкой мускулатуры мочевыводящих путей и как следствие на уродинамические показатели, приводимые из клинических исследований данные об отсутствии усугубления клинической симоптоматики (IPSS), а в ряде исследований и улучшение ее на ТЗТ подталкивают к выводу о том, что ТЗТ у гипогонадных мужчин и СНМП/ДГПЖ может иметь положительные эффекты. А осторожность и относительные п/показания для назначения при IPSS > 19 у пациента связаны с отсутствием достаточного клинического опыта, т.к. такая категория больных исключалась из клинических исследований. Также, обновленные рекомендации отдали пальму первенства при инициации ТЗТ не просто коротко-действующим формам, а именно гелю тестостерона, что с точки зрения безопасности позволит быстро скорректировать или отменить терапию, в случае возникновения нежелательных явлений. (29).
Это лишний раз подтверждает безопасность правильно назначенной ТЗТ и существенно расширяет показания к ней, поскольку, согласно фундаментальным концепциям, относящимся к дефициту тестостерона и его лечения, и консенсусным рекомендациям международных экспертов,
«ДТ – хорошо описанное клинически значимое медицинское состояние, неблагоприятно влияющее на половую жизнь, репродуктивную функцию, общее состояние здоровья и качество жизни мужчины. ДТ представляет угрозу общественному здоровью во всем мире, а терапия тестостероном у мужчин с ДТ является эффективным и целесообразным методом лечения, основанным на доказательных данных [30].
Симптомы нижних мочевых путей (СНМП): что должен знать клиницист?
Симптомы нижних мочевых путей (СНМП) – понятие, сравнительно недавно ставшее общеупотребительным и объединяющее очень широкий спектр жалоб, являющихся проявлениями самых разных заболеваний, и не только ДГПЖ. Термин СНМП, изначально обозначавший совокупность симптомов расстройства мочеиспускания у больных доброкачественной гиперплазией предстательной железы (ДГПЖ), все более часто фигурирует в публикациях о нейрогенном мочевом пузыре, цистите и уретрите у женщин, раке простаты и хроническом простатите. Столь широкая популярность термина объясняется общностью клинических проявлений различных заболеваний нижних мочевых путей. В основе механизма формирования СНМП обычно лежит наличие у больных обструктивного мочеиспускания и/или ирритативных нарушений [1,2] (Таблица 2)

Таблица 2. Рабочая классификация СНМП
Сегодня клиницисту важно знать, что СНМП – это многофакторное состояние. Они могут встречаться в практике врача любой специальности [31] (рис. 1.).
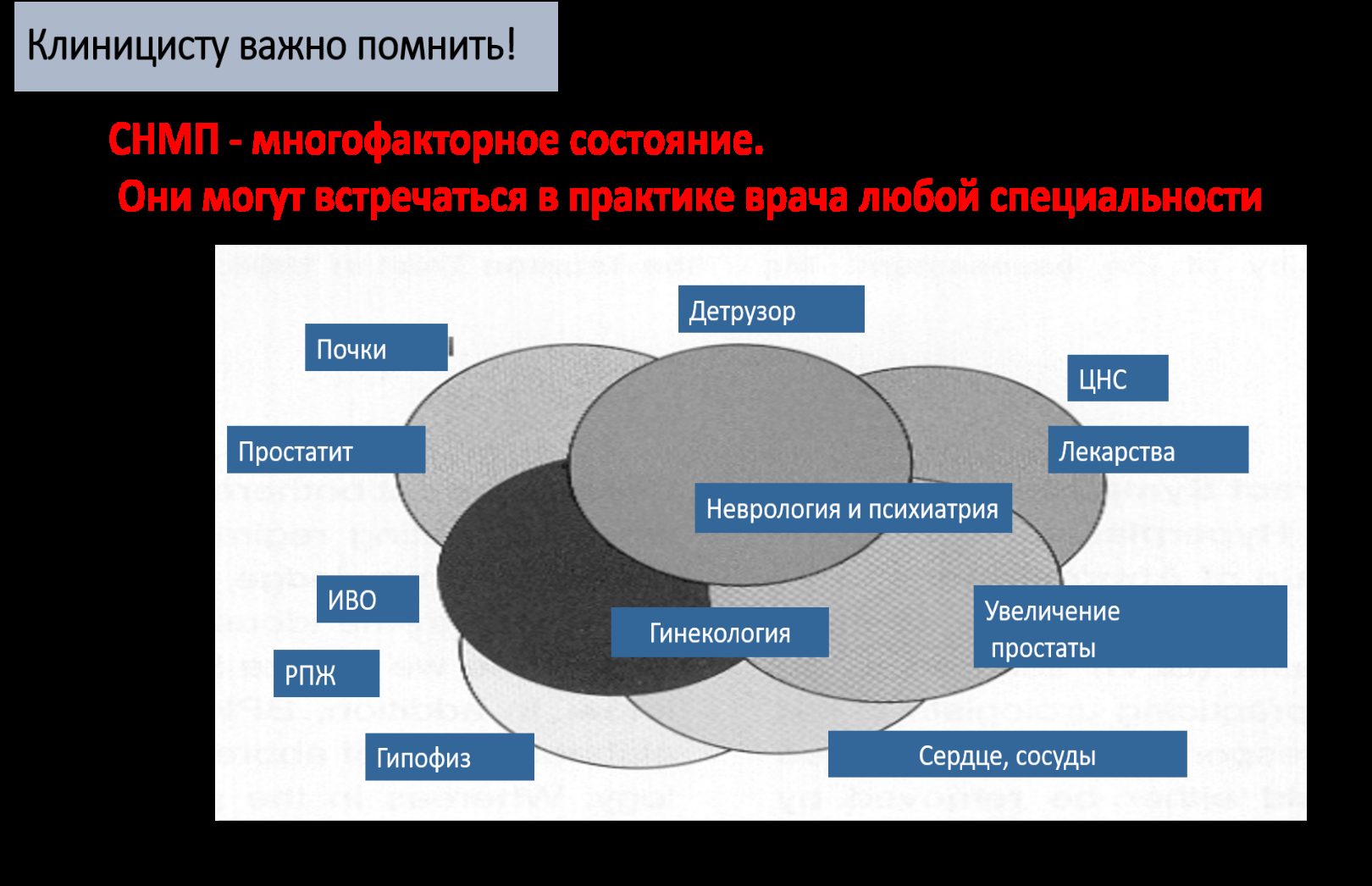
ИВО–инфравезикальная обструкция
РПЖ–рак предстательной железы
ЦНС–центральная нервная система
Рис. 1. Многообразие причин СНМП
Клиницисту также важно знать, что СНМП и особенно ноктурия, оказывающая наихудшее из всех СНМП влияние на качество жизни стареющего человека, не являются прерогативой только мужчин! [32] (рис. 2.).
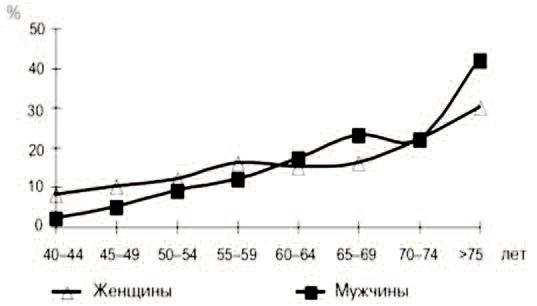
Рис. 2. Распространенность ноктурии в различном возрасте у мужчин и женщин
Наконец, клиницисту важно знать, что в нижних отделах урогенитального тракта имеется обильная рецепция к гормонам, прежде всего, к половым стероидным гормонам (прогестерону, андрогенам, эстрогенам) и витамину D (который тоже является мощным стероидным гормоном, биохимически связанным с половыми стероидными гормонами), которые влияют на анатомо-функциональное состояние практически всех структур тазового дна и тазовых органов, что привносит эндокринологическую специфичность в лечение любых СНМП [32] (рис. 3.).
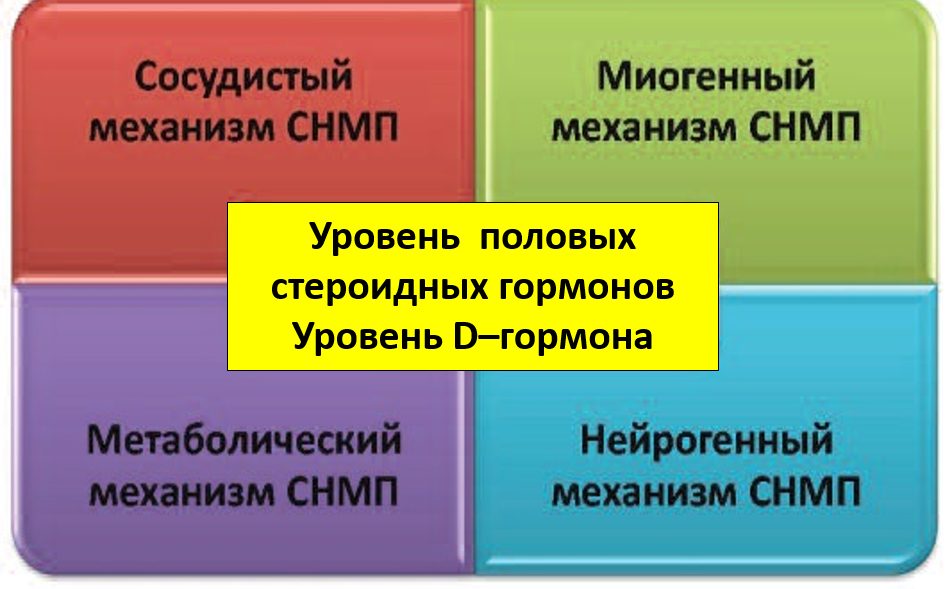
Рис. 3. Взаимоотношения гормонов и различных механизмов СНПМ
Так, потенциальные способности тестостерона в улучшении результатов лечения хронического бактериального простатита были высказаны сначала в виде гипотезы, а вскоре блестяще клинически доказаны в недавних работах отечественных ученых [33,34].
Возрастные эпидемиологические корреляции СНМП/ДГПЖ и дефицита тестостерона
К настоящему времени накоплен огромный научный потенциал высокого уровня доказательности, согласно которому между СНМП/ДГПЖ и дефицитом тестостерона существуют достоверные корреляционные связи [12] Частота СНМП/ДГПЖ у мужчин увеличивается с возрастом и достигает 50% в возрасте старше 50 лет, как и частота возрастного гипогонадизма, также прогрессирующая в связи с возрастом мужчины и составляющая у мужчин в возрасте старше 50 лет примерно 38,7% [35–42].
Исследование эпидемиологической распространенности ДГПЖ в мире и в России является сложной для изучения задачей, поскольку имеется множество факторов, влияющих на частоту регистрируемой заболеваемости [43,44]. Сведения о распространенности данного заболевания в мире неточны и весьма противоречивы, а данные по разным странам могут существенно разниться. Так, частота выявления ДГПЖ у мужчин в Канаде составила 23%, в Шотландии – от 14% в возрасте 40 лет до 43% в возрасте 60 лет, во Франции – 14%, в Нидерландах – до 30%, в Германии – около 30% мужчин 50–80 лет имели различные СНМП/ДГПЖ. В кавказской популяции 13% мужчин в возрасте 40–49 лет и 28% пациентов старше 70 лет имели средне–тяжелые СНМП/ДГПЖ [45–49].
Обращает на себя внимание также своеобразный современный эпидемиологический тренд увеличения частоты ДГПЖ в популяции мужчин из Юго-Восточной Азии и Центральной Африки, у которых еще недавно заболеваемость ДГПЖ была самой низкой в мире, но сегодня в связи с целым рядом социальных, миграционных, алиментарных факторов они постепенно входят в тренды заболеваемости ДГПЖ, характерной для европейских и американских мужчин [50,51].
Среди российских мужчин старше 50 лет число нуждающихся в лечении СНМП/ДГПЖ в 2001 году составляло 2,2 – 6,3 млн. человек, т.е., примерно 14% – 40% [ 52]. Сегодня эти цифры могут быть смело увеличены, так как распространенность ДГПЖ в РФ постоянно нарастает с увеличением возраста пациентов: от 11,3% в возрасте 40–49 лет до 81,4% в возрасте 80 лет на фоне некоторого увеличения продолжительности жизни российских мужчин [1,2]. Заболеваемость ДГПЖ в России с начала века возросла в среднем в 1,5 раза, составив к 2009 году 2221,5 случаев на 100 000 взрослого мужского населения, а к 2012 году этот показатель дополнительно вырос до 2489,4 [53].
Одновременно, по данным отечественных исследований, доля мужчин, обращающихся к урологам по поводу ДГПЖ, составляет не более 7% от предполагаемого числа лиц с клинической симптоматикой [54]. Такая низкая активная выявляемость ДГПЖ приводит к поздней диагностике, прогрессированию заболевания и развитию осложнений, требующих дорогостоящего стационарного лечения. Это выводит данное заболевание в ряд первоочередных медицинских, социальных и экономических проблем российского здравоохранения [55].
Общепринято, что средний возраст появления СНМП/ДГПЖ— 50–60 лет, хотя во многих странах, в том числе, и в России симптомы ДГПЖ выявляют уже у 40% мужчин в возрасте до 50–60 лет. Статистика также указывает, что первые симптомы ДГПЖ могут манифестировать у мужчин даже после 40 лет, и это актуально в отношении мужчин гормонально–метаболически дискредитированных мужчин, а также мужчин, чьи отцы в свое время тоже страдали данным заболеванием, что подчеркивает важную роль наследственной предрасположенности к развитию ДГПЖ [56]. Предрасположенность к увеличению предстательной железы может быть связана, в частности, с полиморфизмом гена андрогеновых рецепторов: у мужчин с меньшим числом триплетов CAG в гене андрогенного рецептора («короткий рецептор») вероятность развития аденомы предстательной железы выше, чем у тех, ген которых содержит большее число этих триплетов («длинный рецептор») [57,58]. В возрасте старше 65 лет СНМП/ДГПЖ выявляются уже у 30–50% мужчин, а пик заболеваемости приходится на возраст 70–80 лет, достигая показателя в 90%, что отражает выраженный возраст–зависимый характер данного заболевания, при этом количество мужчин, у которых выявляются СНМП/ДГПЖ удваивается с каждой декадой их жизни [59–63].
Примерно такие же возрастные тренды увеличения частоты снижения синтеза и секреции тестостерона можно наблюдать у мужчин по мере их старения. Общеизвестен факт того, что начиная примерно с 30–40-летнего возраста уровень тестостерона снижается примерно на 1–2% в год [64,65].
Однако, он неодинаков у мужчин одного возраста и зависит от многих факторов – образа жизни, наличия сопутствующих заболеваний, вредных привычек, генетических и конституциональных особенностей, исходного уровня секреции тестостерона на его пике в 20 лет, особенностей рецепторного аппарата, уровня глобулина, связывающего половы стероиды (ГСПС) и т.д., поэтому и сроки наступления возрастного дефицита тестостерона у всех мужчин строго индивидуальны [66]. Таким образом, если диагноз СНМП/ДГПЖ сегодня сравнительно быстро и легко может быть поставлен уже амбулаторном приеме уролога, то дефицит тестостерона ( в том числе, возрастной) требует от врача клинического мышления и профессионального кругозора.[67].
Вот почему следует согласиться с мнением академика А.А. Камалова, который в одной из своих недавних статей писал, что зачастую верификация возрастного андрогенного дефицита не всегда возможна из-за недостаточной компетентности специалистов как широкого (терапевты, врачи общей практики), так и узкого профиля (эндокринологи, урологи, кардиологи). Возможно, данные , приведенные в этой статье, а также тенденция в различных профессиональных ассоциаци в смене взглядов на гипогонадизм как отягощающую течение основного заболевания коморбидность позволят урологам, а также врачам других специальностей шире смотреть на проблему СНМП/ДГПЖ. [68].
Заключение
В настоящее время дефицит тестостерона представляет собой довольно четкий клинико–лабораторный синдром со своим кодом в МКБ-10, большое количество регламентирующих документов, что позволяет проводить его активное выявление и лечение эффективными и безопасными препаратами тестостерона, доступными как в мире, как и в России. Безусловно, существуют официальные показания для ТЗТ, однако, в силу полифункциональных физиологических эффектов тестостерона и выраженной андрогенозависимости нижних отделов урогенитального тракта и тазового дна они могут быть с успехом и пользой для наших пациентов расширены и уже расширяются для применения в составе комплексной фармакотерапии СНМП, обусловленных различными заболеваниями предстательной железы.